On estime que le cytomégalovirus (CMV) infecte entre 60 et 70 % des adultes dans les pays industrialisés et près de 100 % des adultes dans les pays en voie de développement (Gupta et Shorman 2024).
Il se transmet par contact avec des fluides corporels infectés, généralement la salive, l'urine, le sang ou les sécrétions génitales. Le virus peut être transmis de la mère au fœtus à n'importe quel moment de la grossesse, mais il est le plus susceptible de causer de graves séquelles pour le fœtus lorsque la mère est primo-infectée pendant le 1er trimestre de la grossesse. L’infection congénitale au CMV peut entraîner des séquelles telles que des troubles neurodéveloppementaux et cognitifs, la perte d'audition, les troubles de l’équilibre, la déficience visuelle qui sont présentes à la naissance ou qui se développeront au cours des 7 premières années de l’enfant.
Alors que la science démontre qu'un dépistage, accompagné de traitements adaptés, peut significativement réduire la transmission du virus à l'enfant et ses séquelles, le dépistage de l'infection congénitale au CMV n'est toujours pas recommandé en France. Il semble pourtant essentiel de mettre en place un dépistage systématique dès le début de la grossesse, à l'image de ce qui est déjà fait pour d'autres infections comme la toxoplasmose.
Toutes les femmes en début de grossesse ou ayant un projet de grossesse doivent avoir accès à l’information.

Épidémiologie et caractéristiques du CMV
Le cytomégalovirus humain (CMV), aussi appelé Human Herpes Virus 5 (HHV-5) appartient à la famille des virus de l’herpès. Il est spécifique aux humains et endémique en France, c’est-à-dire qu’il est présent toute l’année. C’est l’infection congénitale la plus courante, affectant 0,5 à 2 % des nouveau-nés (Leruez-Ville et al. 2020). Le CMV peut infecter un grand nombre de différents types de cellules dans l’organisme (peau, muscles, nerf, vaisseaux sanguins, foie…).
Ce virus est caractérisé par deux propriétés biologiques fondamentales de cette famille de virus : la latence et la réactivation. Cela signifie que le CMV, une fois contracté, reste présent à vie dans le corps à l’état dormant (phase de latence) et peut se réveiller au décours d’une baisse de l’immunité (phase de réactivation).
La primo-infection ou infection primaire maternelle à CMV désigne la première fois qu'une personne contracte ce virus. Lors de cette infection initiale, le virus se réplique activement dans le corps de la femme enceinte, ce qui peut provoquer des symptômes souvent légers (fièvre isolée ou syndrome pseudo-grippal avec fièvre persistante le plus souvent) ou absents chez les personnes en bonne santé. La primo-infection est particulièrement préoccupante pendant la grossesse, car elle peut entraîner une transmission au fœtus, causant des complications parfois sévères.
La latence survient après une infection, le CMV reste dans le corps à l'état dormant, comme les autres virus de la famille des herpès virus. Le virus se cache dans différents types de cellules, comme les cellules des vaisseaux sanguins, de la peau ou encore des muscles, offrant ainsi de nombreux endroits où il peut rester en sommeil. Le virus peut rester inactif dans ces cellules pendant des années. La latence signifie qu'il n'y a pas de production active de nouveaux virus, et le système immunitaire de la personne infectée contrôle l'infection (Hantz et Boutolleau 2019).
L’infection secondaire correspond à une réactivation du virus latent ou une réinfection par d’autres souches du virus de la mère :
Réactivation : Chez une personne avec un système immunitaire normal, le virus se réactive de temps en temps, provoquant des périodes où le virus est libéré par intermittence dans les sécrétions respiratoires, l'urine, le sperme et les sécrétions cervicales, qui deviennent des sources possibles de transmission. Des épisodes de réactivation peuvent survenir lorsque l'immunité de la personne infectée est compromise, par exemple, lors d’une immunodéficience comme le VIH, après une greffe d'organe ou lors d’une grossesse. Lors de la réactivation, le virus est excrété dans les fluides corporels ce qui permet sa transmission à d'autres individus (Leruez-Ville et al. 2020).
Réinfection par d’autres souches de virus : Le génome du CMV varie beaucoup, ce qui permet l'existence de nombreuses souches différentes du virus. Cette diversité est due à des mutations et recombinaisons génétiques fréquentes. L’immunité acquise pour une souche ne protège pas parfaitement contre une autre souche, ce qui explique la possibilité d’être à nouveau infecté par le CMV. Cette réinfection, bien que possible, est tout de même bien moins fréquente que la primo-infection.
Mieux comprendre l'infection congénitale à CMV (dossier complet)
Face à cet enjeu de santé publique, la Fondation Pour l'Audition a créé un dossier thématique qui explore les conséquences d'une infection congénitale au cytomégalovirus chez la mère, le fœtus et le nouveau-né, ainsi que son impact sur l'audition de l'enfant.
Portrait robot de la maman à risque et taux de transmission viral
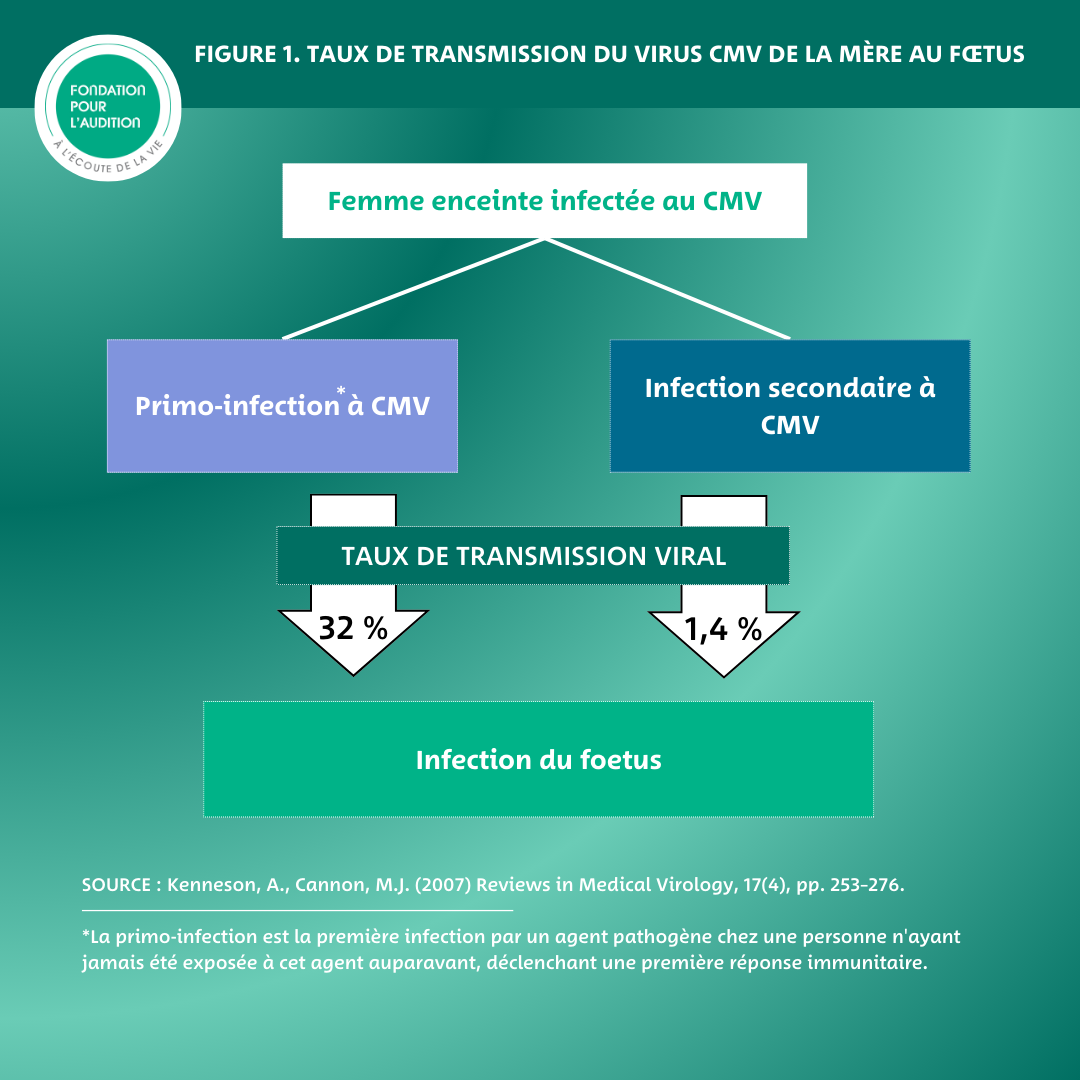
Le CMV peut se transmettre de la mère à l'enfant pendant la grossesse. Ce passage du virus peut être particulièrement grave si c’est une primo-infection, car l’organisme ne connait pas le virus, et si elle a lieu au premier trimestre de la grossesse, période critique où se forment les organes.
Depuis de nombreuses années, le Pr Yves Ville, directeur du service d’obstétrique de médecine fœtale de l’hôpital Necker Enfants-malades, AP-HP et coordonnateur du Centre Pluridisciplinaire de Diagnostic Prénatal, dirige un service de pointe pour les grossesses liées à une infection au CMV en France. Et il observe une répétition, quasi systématique du profil des grossesses concernées : « Les femmes qui s’infectent pour la première fois sont très souvent des femmes enceintes qui n’ont pas été infectées par le CMV lors de la première grossesse, elles ont moins de 35 ans, appartiennent à une catégorie socio-économique assez élevée, travaillent et ont un premier enfant de moins de trois ans, gardé en collectivité. Ces femmes ont un risque de 10 % d’attraper ce virus au premier trimestre de leur grossesse et, lorsqu’elles sont infectées, le risque de le transmettre à leur embryon est de 32 % (Kenneson et Cannon 2007). »
Le taux de transmission varie en fonction du moment de l’infection et du type d’infection maternelle. « Le risque de transmission fœtale en cas de primo-infection en période périconceptionnelle (dans les 11 semaines précédant la conception de l’enfant) est faible mais réel. Ce risque semble inexistant lorsque l’infection maternelle survient plus de 11 semaines avant la conception (Revello et al. 2002; Feldman et al. 2011). » poursuit-il.
En cas de réinfection au CMV, le taux de transmission ne serait que de 1,4 % (Kenneson et Cannon 2007). Néanmoins, si le risque de contamination du fœtus est très faible, il faut noter que les séquelles pour le fœtus sont de gravité quasi équivalente (Giannattasio et al. 2017).
Quelles conséquences possibles pour le fœtus et le nouveau-né ?
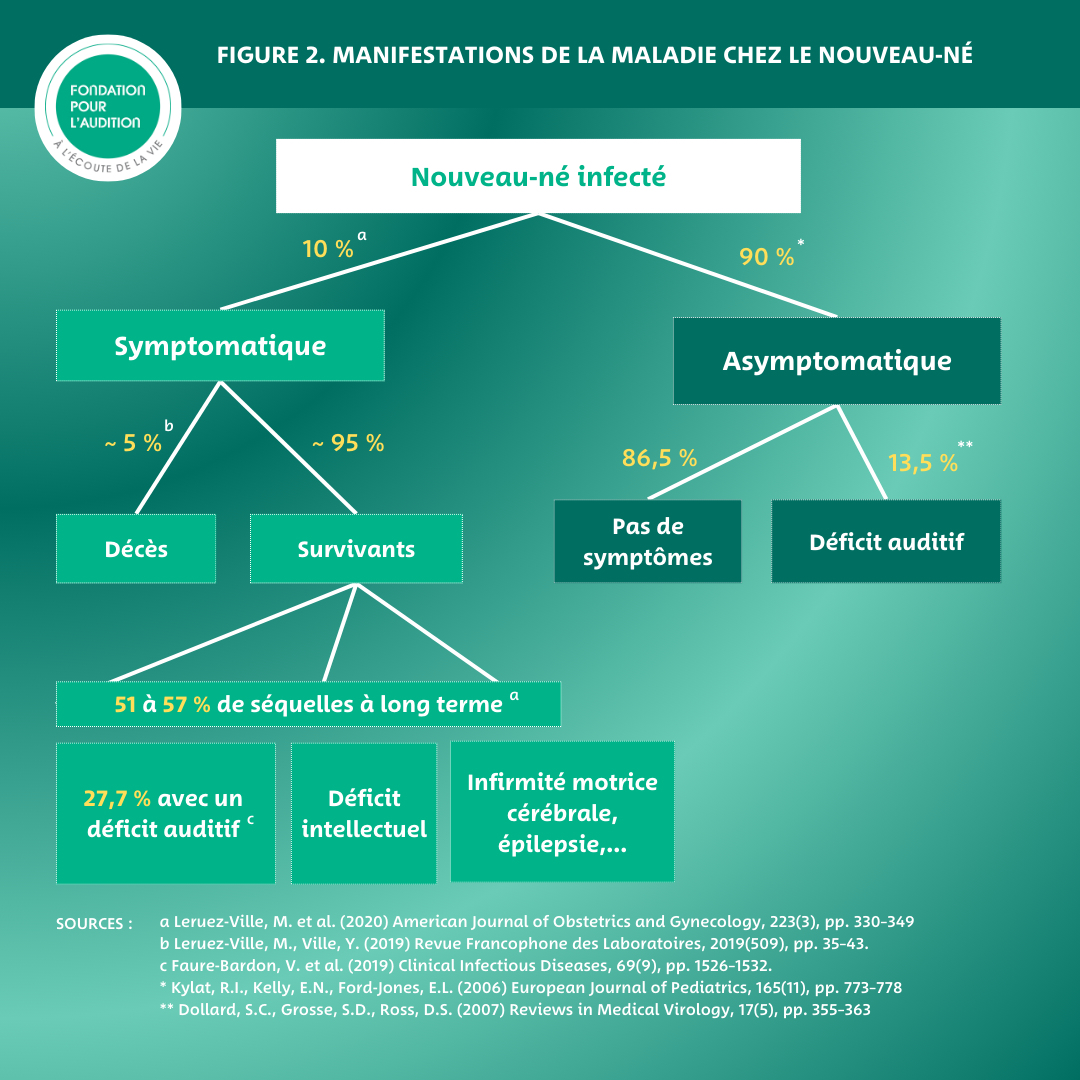
Dix pourcents des fœtus infectés par le CMV lors de la grossesse présentent des symptômes à la naissance (Leruez-Ville et al. 2020). On parle d’enfant ou de maladie symptomatique.
La maladie congénitale symptomatique survient le plus souvent après une primo-infection pendant le premier trimestre de la grossesse. « La proportion de séquelles à long terme est de 51 à 57 % pour ces nouveau-nés exposés pendant le 1er trimestre (Leruez-Ville et al. 2020). Un nouveau-né est considéré comme symptomatique s'il présente des signes cliniques d'infection à la naissance, tels qu'un faible poids, une jaunisse, des éruptions cutanées, une hépatosplénomégalie (augmentation de la taille du foie et de la rate), des problèmes respiratoires, ou des anomalies au niveau des yeux ou de l'ouïe. » poursuit le Pr Ville.
La Société Canadienne de Pédiatrie documente les principales séquelles liées à une infection congénitale au CMV chez l’enfant symptomatique à la naissance comme suit (Barton, Forrester, et McDonald 2020):
- Les déficits moteurs sévères touchent environ 15 % à 25 % de ces enfants.
- Microcéphalie (tête de petite taille) dans 35 à 40% des cas
- 42 % des nourrissons sont affectés par des troubles neurodéveloppementaux, et 50 % à 70 % par des déficits cognitifs.
- 15 % à 20 % des enfants souffrent de crises d'épilepsie.
- La surdité neurosensorielle est présente chez 27 % à 69 % des nourrissons. La majorité de ces enfants sourds souffrent également de troubles vestibulaires (Bernard et al. 2015)
- Des anomalies oculaires sont observées chez 25 % à 50 % des enfants.
Dans 90 % des cas, une infection à CMV à la naissance est asymptomatique pour le nouveau-né (Kylat, Kelly, et Ford-Jones 2006). Cependant, parmi ces enfants asymptomatiques à la naissance, il faut noter également qu’environ 13,5 % d’entre eux développeront par la suite des séquelles permanentes jusqu’à l’âge de 7 ans, principalement des surdités (Dollard, Grosse, et Ross 2007), probablement suite à une réactivation du CMV.
« En tenant compte des enfants présentant des symptômes à la naissance ainsi que de ceux qui développent des séquelles en grandissant, environ 20 % des enfants infectés par le CMV vont souffrir de séquelles à long terme : environ 1/3 dans le groupe symptomatique et 2/3 dans le groupe asymptomatique (Dollard, Grosse, et Ross 2007). La gravité des séquelles peut varier considérablement, allant d’une surdité à une infirmité motrice cérébrale majeure. Les deux principaux facteurs qui influencent le risque de séquelles sont la présence de symptômes à la naissance et le moment de l'infection maternelle pendant la grossesse », concluent le Pr Ville et le Dr Leruez.
LE CMV, première cause de surdité infectieuse congénitale chez l'enfant
Les infections à CMV chez l'enfant sont la principale source congénitale de handicaps neurosensoriels dont notamment des surdités progressives (Kabani et Ross 2020).
Une étude de 2019, portant sur 255 femmes et leurs enfants entre 2011 et 2017, a montré que 27,73 % des enfants présentaient des surdités après une infection maternelle primaire (Faure-Bardon et al. 2019).
La surdité peut se manifester d'emblée ou être secondaire parfois tardive ; elle se caractérise par sa forte propension à évoluer vers une surdité profonde une fois déclarée. Elle concerne tout le spectre auditif sans atteinte fréquentielle préférentielle.
Quel dépistage et QUELLE prise en charge des femmes enceintes ?
À l’heure actuelle, l’Assurance Maladie préconise un dépistage ciblé avec une prise de sang à la recherche d'une infection récente à CMV uniquement si des symptômes évocateurs apparaissent (Assurance Maladie 2024) :
Chez la mère, l'apparition d'un syndrome grippal avec fièvre, fatigue et maux de tête, survenant sans cause évidente, peut amener le médecin ou la sage-femme à prescrire une sérologie.
Chez le fœtus, il s'agit d'anomalies vues à l'échographie (retard de croissance intra-utérin, taille de la tête insuffisante, anomalies du cerveau, foie augmenté de volume, anomalies placentaires).
Si l’infection récente est confirmée, une surveillance de la grossesse, dans un centre de diagnostic anténatal, avec échographie mensuelle est mise en place.
Une amniocentèse permettant la recherche du virus dans le liquide amniotique est réalisée en cas d'anomalies à l'échographie. À la naissance, le bébé est régulièrement suivi.
En cas d’atteinte très sévère du fœtus, une interruption de grossesse thérapeutique peut être proposée par l'équipe médicale.
« Au-delà des campagnes d’information et de prévention, il est essentiel que les futures mamans se fassent dépister dès qu’elles apprennent leur grossesse et une seconde fois à la fin du premier trimestre vers 12 semaines. Une simple prise de sang permet de doser les anticorps (IgM et IgG) et de connaitre son statut sérologique. Si la biologie est positive, il faudra alors comprendre à quel moment le virus a été contracté. La période de contamination est décisive, la biologie sanguine permet de savoir si l’infection a eu lieu pendant la grossesse ou non. La durée d'incubation est de 2 à 4 semaines. Le risque de séquelles graves est plus important lorsque le CMV est contracté dans les deux mois avant la conception ou au premier trimestre de la grossesse. Seul le dépistage permet de savoir », insistent le Dr Leruez et le Pr Ville.
Le Pr Ville poursuit : « Seules 40 % des femmes enceintes ont accès à une sérologie, surtout dans les grandes métropoles, il y a une véritable inégalité d’accès à l’information selon le lieu d’habitation. La plupart des mères, dont les enfants gardent des séquelles liées au CMV, n’avaient jamais entendu parler de ce virus. Ces femmes doivent être au courant car nous savons aujourd’hui délimiter la période à risque et les dépister » souligne le spécialiste.
|
Plusieurs options peuvent alors se présenter lors de la prise de sang de début de grossesse : Si le résultat est négatif, les femmes ne sont pas immunisées en début de grossesse et il faudra recontrôler qu’elles n’ont pas été exposées au virus autour de 16 semaines de grossesse. Dans cet intervalle, elles devront respecter strictement les gestes barrières. Soit les femmes sont immunisées (IgG positifs et IgM négatif), il s’agit alors d’une infection ancienne, une réinfection peut survenir, celle-ci ne se transmet au fœtus que dans 1 à 2 % des cas. Elle peut malgré tout entrainer un passage transplacentaire et un risque neurosensoriel. La réinfection est cependant plus difficile à identifier. Soit les femmes ont des IgM positifs, il est alors nécessaire d’effectuer un test d’avidité. Si l’avidité est basse, cela signifie que l’infection est récente, cela concerne 0,5 à 1% des grossesses et dans ce cas précis, la grossesse doit être prise en charge de façon spécifique. |
Le dépistage universel et précoce des femmes enceintes est essentiel pour deux raisons, explique le Pr Ville : « d’une part car les infections graves sont celles qui surviennent après les primo-infections du premier trimestre et d’autre part, car un traitement peut être donné, en cas d’infection au premier trimestre pour prévenir l’infection du fœtus. Ce traitement est efficace dans les deux tiers des cas, à condition qu’il soit commencé très tôt après cette primo-infection. Sans sérologie, il n’y a rien, il n’y a pas le moindre signe clinique pour nous mettre sur la piste, la primo-infection est asymptomatique. Même si la contamination a eu lieu au premier trimestre, période à laquelle tous les risques de séquelles sont concentrés, nous savons prendre en charge ces patientes. Deux informations sont essentielles à connaître ; si oui ou non le virus est passé et si l’infection est sévère ou non. Il y a là un double enjeu, premièrement : informer les femmes d’un risque non négligeable et deuxièmement, si elles sont infectées, pouvoir les traiter. En résumé, le dépistage sérologique du CMV dans le premier trimestre de la grossesse permet de transformer des risques en opportunités pour toutes les femmes enceintes. »
Il n’existe pas, à ce jour, de consensus en France sur la prise en charge thérapeutique d’une primo-infection maternelle au cours de la grossesse. La prise en charge décrite ci-après correspond à celle proposée par le service d’obstétrique de médecine fœtale de l’hôpital Necker Enfants-malades, AP-HP à Paris.
Le traitement antiviral
« Quand une primo-infection est détectée au premier trimestre ou trois mois avant la grossesse, les femmes enceintes peuvent être traitées par valaciclovir[1] » explique le Dr Leruez. « C’est un médicament antiviral très connu qui est donné contre l’herpès. Une réduction de 71 % de l’infection fœtale a été rapportée dans un essai clinique chez des femmes primo-infectées au cours de leur premier trimestre de grossesse et traitées avec le valaciclovir (Shahar-Nissan et al. 2020). Le traitement est assez contraignant, les femmes doivent prendre 8 g de médicament par jour en 4 prises soit 2 g toutes les 6 heures, mais il permet deux fois sur trois d’éviter le passage du virus de la mère à l’enfant. Ce traitement est bien toléré et la note du Centre de Référence sur les Agents Tératogènes, qui a valeur de référence en matière de traitement pour la femme enceinte, mentionne que le traitement par valaciclovir est possible quel que soit le terme de la grossesse, la posologie et la durée du traitement (Centre de Référence des Agents Tératogènes - Hôpital Trousseau, Paris 2024) » conclut le Dr Leruez.
Examens complémentaires et suivi
Une fois le traitement mis en place, il est possible de proposer aux parents, très tôt dans la grossesse une biopsie du trophoblaste (prélèvement d’une petite quantité de cellules du placenta entre 11 et 14 semaines d’aménorrhée) ou si la grossesse est plus avancée, une amniocentèse précoce (prélèvement d’une petite quantité de liquide amniotique) sera recommandée. Il conviendra de la réaliser autour de la 17ème semaine d’aménorrhée.
« Là encore, il y a plusieurs options : dans deux tiers des cas, grâce notamment au traitement, le fœtus n’est pas infecté : tout le monde est soulagé, nous arrêtons la prise d’antiviral. Pour le dernier tiers, l’amniocentèse est positive, le fœtus est infecté. Il convient alors de continuer le traitement jusqu’à la fin de la grossesse, mais surtout nous connaissons les signes à surveiller et dans ce cas précis, nous proposons une échographie approfondie combinée avec une IRM fœtale. L’expertise échographique des fœtus connus comme infectés est très pertinente et permet de mieux repérer les signes de gravité mais également de suivre l’évolution de l’infection qui est un phénomène continu et évolutif. Pour un fœtus infecté dont l’imagerie échographique et l’IRM sont strictement normales, le seul risque qui reste imprévisible, est une baisse d’acuité auditive. Le traitement divise par 5 le risque de séquelles graves, lorsqu’il échoue à bloquer le passage de celui-ci. Pour les fœtus infectés, nous mettons en place une surveillance rapprochée tous les 15 jours, si le pronostic est associé à des séquelles graves, nous proposons aux parents une consultation pluridisciplinaire qui leur permet légitimement, en connaissance des risques, de poursuivre ou d’interrompre cette grossesse. » rapporte le Pr Ville.
Perspective thérapeutique : un vaccin bientôt sur le marché ?
La biotech américaine Moderna teste un vaccin à ARN messager contre le cytomégalovirus chez 7300 femmes non enceintes. Cette étude CMVictory a été conçue pour évaluer l'efficacité, la sécurité et l'immunogénicité du médicament (Hu et al. 2024).
[1] Ce médicament n’a, pour le moment, pas reçu d’autorisation de mise sur le marché pour être utilisé dans les infections congénitales à cytomégalovirus chez la femme enceinte. Il peut être prescrit au cas par cas par un médecin.
Quelle prise en charge de la surdité chez l'enfant due à une infection congénitale à CMV ?
Lorsqu'il y a des signes cliniques évocateurs de la maladie à la naissance ou lorsque l’on a identifié une infection chez la mère en cours de grossesse, la salive ou les urines des nouveau-nés sont testés dans les premiers jours de vie. S’ils sont positifs au CMV et présentent des symptômes, ils peuvent alors bénéficier d’un traitement antiviral plus ciblé, le ganciclovir ou le valganciclovir[1]. Administré précocement aux nouveau-nés symptomatiques, le traitement montre une légère efficacité dans la stabilisation ou la préservation temporaire de la fonction auditive (Kimberlin et al. 2003). Cependant, en cas de surdité sévère à profonde, le traitement n’a pas démontré d’efficacité et ne doit pas retarder la réhabilitation auditive.
[1] Ces 2 médicaments n’ont, pour le moment, pas reçu d’autorisation de mise sur le marché pour être utilisé dans les infections congénitales à cytomégalovirus chez l’enfant. Ils peuvent être prescrit au cas par cas par un médecin.
La surdité peut apparaître immédiatement après la naissance ou de façon retardée et évoluer vers une surdité profonde. Chez les enfants symptomatiques, cette surdité est souvent sévère et bilatérale, nécessitant l'utilisation d'un appareillage auditif ou d'un implant cochléaire, un dispositif de réhabilitation auditive conçu pour restaurer ou développer la communication orale.
Les enfants nés asymptomatiques développent également des surdités progressives, souvent initialement unilatérales, mais pouvant aussi être bilatérales dès le début. La prise en charge dans ces cas repose également sur un appareillage auditif ou un implant. L’étude du Dr Cushing a montré que plus de 65 % des surdités unilatérales évoluent vers une surdité bilatérale avec le temps (Cushing et al. 2022).
« Au-delà du traitement, la prise en charge ORL précoce est essentielle » insiste le Pr Teissier, « l’identification du déficit auditif permet de proposer une stimulation précoce car, si les circuits auditifs ne sont pas sollicités très tôt, le cortex auditif sera réattribué au cortex visuel. En termes de suivi, nous pouvons proposer un appareillage précoce et adapté, ainsi que de l’orthophonie. Si l’audition se dégrade et évolue vers une surdité profonde, l’enfant pourra bénéficier d’un implant cochléaire. »
« Il convient également de vérifier la fonction vestibulaire ; en effet, l’oreille interne comporte non seulement l’organe de l’audition mais aussi celui de l’équilibre. Si celui-ci est atteint, l’enfant peut présenter un retard postural, à la marche ou une instabilité. Nous proposons alors à la famille des séances de kinésithérapie adaptée pour limiter le retentissement. Cet aspect-là n’est pas à négliger, car un vestibule altéré peut avoir des conséquences sur la qualité de la lecture, de l’écriture, mais également favoriser les troubles de l’attention. » appuie le Pr Teissier.
Dans une étude évaluant les troubles vestibulaires, ou troubles de l’équilibre, chez les enfants infectés par le cytomégalovirus congénital, les résultats montrent que 92,3% des 52 enfants étudiés, dont la majorité avaient eu une forme symptomatique de la maladie à la naissance, présentaient à la fois une perte auditive et des troubles vestibulaires (Bernard et al. 2015). Parmi ces troubles, 33,3% étaient complets et bilatéraux, 43,7% partiels et bilatéraux, et 22,9% partiels et unilatéraux. Les tests sériels effectués sur 14 enfants ont montré une stabilité de la fonction vestibulaire dans 50% des cas et une détérioration dans les 50% restants. L'infection congénitale par le CMV peut avoir un impact négatif sur le développement postural, corrélé à des déficiences neurologiques et vestibulaires.
Le Pr Teissier souligne l'importance de dépister les séquelles vestibulaires, moins connues mais ayant un impact significatif sur la vie de l’enfant : « Les troubles vestibulaires sont fréquemment associés aux troubles auditifs, bien que leurs niveaux de gravité ne soient pas toujours corrélés. Ces troubles, courants et souvent graves chez les enfants infectés par le CMV, mettent en évidence la nécessité d'un dépistage systématique et d'une prise en charge appropriée des lésions vestibulaires pour permettre des soins adaptés. »
PRÉVENTION - les gestes barrières indispensables
Alors que le CMV constitue la première cause de handicap neurosensoriel non génétique acquis pendant la vie intra-utérine, aujourd’hui, ce virus ne bénéficie d’aucun dépistage systématique et d’aucune campagne d’information et de sensibilisation aux gestes barrières.
« Il faut expliquer aux femmes enceintes que le virus s’attrape au contact d’un jeune enfant. En collectivité, les petits sont très souvent infectés par ce virus. Les personnes qui s'en occupent ont donc de grandes chances d’être en contact avec le CMV » explique le Dr Leruez.
Les gestes barrières sont simples, font appel au bon sens mais sont indispensables :
- Bien se laver les mains après chaque change de couches et chaque contact avec de la salive
- Utiliser de l’eau et du savon ou une solution hydroalcoolique
- Éviter tout contact avec les urines la salive et les larmes de l’enfant
- Ne pas porter la tétine de l’enfant à la bouche
- Ne pas porter la cuillère, la nourriture ou les jouets de l’enfant à la bouche
- Ne pas l’embrasser sur la bouche
- Le deuxième parent doit prendre les mêmes précautions, car le virus se transmet sexuellement et par la salive
Arguments pour un dépistage systématique chez les femmes enceintes
Une étude publiée dans The Lancet (Shahar-Nissan et al. 2020) a examiné l'efficacité du valaciclovir pour prévenir la transmission du cytomégalovirus chez les femmes enceintes. Cette étude conduite sur 90 femmes enceintes ayant une primo-infection à CMV s’est divisée en deux groupes : 45 femmes ont reçu 8 g par jour de l’antiviral valaciclovir et les 45 autres ont reçu un placebo.
• Les résultats montrent que 11% des femmes dans le groupe ayant reçu le valaciclovir ont transmis le CMV à leur fœtus, contre 30% dans le groupe contrôle.
• Chez celles infectées au premier trimestre, groupe le plus à risque de séquelles sévères pour le fœtus, la transmission était de 11% avec le valaciclovir contre 48% dans le groupe contrôle.
• Aucun effet indésirable significatif n'a été rapporté, ce qui indique que le valaciclovir est une option sûre et efficace pour réduire le risque de transmission fœtale du CMV.
Ce médicament n’a, pour le moment, pas reçu d’autorisation de mise sur le marché pour être utilisé dans les infections congénitales à cytomégalovirus chez la femme enceinte. Il peut être prescrit au cas par cas par un médecin.
Un autre médicament antiviral, le letermovir, est actuellement testé chez des femmes enceintes primo-infectées au Service de Bactériologie, virologie, parasitologie et hygiène de l’hôpital Necker-Enfants Malades AP-HP à Paris. Les résultats attendus en 2029 (Leruez-Ville 2024).
Deux études de référence récentes portant sur les l’intérêt du dépistage du CMV analysent les différentes stratégies de dépistage et de traitement du cytomégalovirus (CMV) chez les femmes enceintes en France (Seror et al. 2022; Périllaud‐Dubois et al. 2023). Elles démontrent que le dépistage universel en cours de grossesse combiné au traitement par valaciclovir est plus efficace et économiquement avantageux par rapport aux pratiques actuelles. Ce dépistage permet de diagnostiquer plus de cas et de prévenir les infections congénitales, tout en étant moins coûteux à long terme. Les résultats de ces études plaident pour la mise en place du dépistage universel en cours de grossesse comme nouvelle norme de soin.
Deux autres évaluations médico-économiques du dépistage de l’infection à CMV pendant la grossesse suivis d’un traitement par valaciclovir ont été conduites aux États-Unis (Fisher et al. 2022) et au Japon (Aoki, Bitnun, et Kitano 2023) en 2022. Leurs conclusions sont plus nuancées que les études françaises.
Malgré les données scientifiques, les analyses médico-économiques et la mobilisation des associations de patients, le dépistage systématique de l'infection à cytomégalovirus pendant la grossesse ne retient pas l’attention de nos législateurs.
Le Haut Conseil de la Santé Publique (HCSP) a émis, à 2 reprises, un avis défavorable à ce dépistage (Haut Conseil de la Santé Publique 2018; 2023). Selon lui, une généralisation du dépistage ne peut être envisagée étant donné les inconnues sur l’efficacité et les risques d’un traitement prolongé à forte dose par valaciclovir sur le devenir du fœtus. Les données disponibles ne permettent pas de conclure à un rapport bénéfice-risque favorable du dépistage du CMV chez la femme enceinte par rapport à la prise en charge courante. L’HCSP met l’accent sur la promotion de mesures préventives efficaces.
Après la publication d’un premier rapport en 2019 (Académie de Médecine 2019), l’Académie de Médecine plaide à nouveau pour un dépistage systématisé des infections à cytomégalovirus chez la femme enceinte (Académie de Médecine 2024).
La Haute Autorité de Santé (HAS) a été saisie par la Direction Générale de la Santé (DGS) le 4 février 2024, après la recommandation défavorable du HCSP et en application de l’article 44 de la loi n°2023-1250 du 26 décembre 2023 de financement de la sécurité sociale pour 2024 pour donner son avis sur l’opportunité de mettre en place « un programme de dépistage du CMV de façon systématique chez la femme enceinte ». Son avis est attendu pour la fin de l’année 2024.
Depuis décembre 2023, un dépistage systématique de l’infection à CMV chez les femmes enceintes est recommandé en Italie (Istituto Superiore di Sanità 2024). L’Australie et le Canada proposent un dépistage ciblé tandis que le Royaume-Uni et l’Allemagne ne recommandent pas ce dépistage (Haute Autorité de Santé 2024).
Témoignages de familles touchées par le CMV
Retrouvez ci-dessous les témoignages de familles touchées par le cytomégalovirus (CMV), mettant en lumière l'importance cruciale du dépistage et de la prise en charge précoce. Anne-Hélène Labissy, présidente de l’association 'Chanter, Marcher, Vivre' (voir son témoignage complet - Combattre « Ce Maudit Virus » par tous les moyens) joue un rôle essentiel en soutenant les parents confrontés au diagnostic du CMV pendant la grossesse. Elle accompagne également ceux qui, après l'accouchement, doivent faire face aux séquelles laissées par ce virus sur la santé de leur enfant. Ces récits soulignent l'urgence de la sensibilisation au CMV et l'impact des actions préventives pour minimiser les risques.
Olivia et Daniel sont les heureux parents d’Alice, elle a deux ans et demi quand Olivia tombe à nouveau enceinte en 2019. Alice va bien et fréquente la crèche. Cette grossesse se passe tout à fait normalement, hormis un petit syndrome grippal au premier trimestre. Mais à la naissance, Noah passe un test d’audition corrélé à la prise d’une goutte de sang (le test de Guthrie) et ce dernier révèle qu’une des deux oreilles entend « moyennement ».
« Noah doit passer un test d’audition trois mois plus tard, mais le COVID étant passé par là, il ne passe finalement ce test qu’à l’âge de huit mois » explique Olivia. Il bénéficiera d’une exploration plus approfondie, appelé test des potentiels évoqués auditifs. Les PEA analysent le fonctionnement des voies de l’audition et permettent d’explorer l’oreille interne, le nerf auditif et la portion moyenne du tronc cérébral. « Les PEA révèlent effectivement la surdité d’une des deux oreilles. L’interne nous reçoit et nous explique qu’il s’agit certainement du CMV, hypothèse qu’il vont vérifier grâce au test de Guthrie. On pose des questions, on nous renvoie chez nous et là en tapant CMV sur internet, on commence à paniquer ! Effectivement Noah a 8 mois, il bouge peu et ressemble à la description du bébé CMV » poursuit Olivia.
La fameuse petite grippe qu’Olivia a contractée au premier trimestre de la grossesse était bien le CMV.
En plus de ses problèmes d’audition, Noah passe toute une batterie d’examen, IRM, tests vestibulaires… ces derniers mettent en lumière une atteinte vestibulaire totale, en plus d’une surdité. « On ne sait pas comment il va marcher ni se tenir debout, il démarre alors un suivi avec des kinés et des psychomotriciens. Noah a un caractère de feu, il persévère, il est intrépide et finalement à 18 mois, il marche ! Aujourd’hui il a 4 ans et demi et vit quasiment comme les autres enfants, il court, il joue, il est même un peu hyperactif. Certes, il tombe plus que les autres et se fatigue car il n’a pas de réflexes, ni les sensations avant la chute, mais grâce à la rééducation et aux exercices, il apprend à faire les bons gestes. » se réjouit la maman de Noah.
En revanche, l’audition continue à se dégrader et il devient sourd profond d’une oreille. Aucun traitement n’a pu être mis en place, car le CMV a été découvert trop tard.
« On espère que l’histoire s’arrêtera là. Mais à l’été de ses deux ans, Noah commence à avoir une attitude étrange, il se replie sur lui. Il passe de nouveaux tests d’auditions à la rentrée et nous apprenons, sidérés, que la surdité s’est bilatéralisée. La machine s’emballe et le corps médical réagit rapidement. En un mois, il est opéré d’une première oreille et équipé d’un premier implant cochléaire et six mois plus tard, il a eu un son deuxième implant. » poursuit Olivia.
Les opérations fonctionnent, Noah est bien pris en charge d’un point de vue ORL et également accompagné par une orthophoniste, il progresse énormément.
« D’un point de vue financier, cela représente beaucoup de sacrifices, par exemple l’intégralité des séances chez le psychomotricien ne sont pas prises en charge malgré ses atteintes vestibulaires. Ce virus nous a beaucoup éprouvés, j’ai dû changer de travail pour passer à temps partiel, nous avons peu voyagé. Les rendez-vous médicaux nous ont beaucoup sollicités et tout cela reste très préoccupant. On s’inquiète encore, on a besoin d’être surs qu’il va bien et qu’on a tout découvert. Le retentissement du CMV a généré beaucoup de stress, c’est un virus mal connu, y compris par les soignants donc on a connu beaucoup d’errance tout au long de ce parcours. Mais ce qui compte c’est que Noah va bien, il joue bien avec sa sœur, ils ont une belle relation, il a plein de ressources. » conclut Olivia.
Aujourd’hui Olivia, Daniel, Alice et Noah avancent et l’ombre du CMV laisse de plus en plus de place à la joie du quotidien.
Sarah et Nicolas ont déjà un petit garçon de 3 ans, Peter, lorsque Sarah entame sa seconde grossesse. Leur sage-femme, teste automatiquement le CMV dès le début de la grossesse, vers 7 semaines d’aménorrhée, les résultats de la prise de sang montrent des IgM positifs et des IgG négatifs, ce qui signifie d’une part que Sarah n’est pas immunisée contre le CMV et d’autre part qu’une infection serait en cours, le test d’avidité, réalisé 15 jours plus tard, confirme cette hypothèse.
Immédiatement, Sarah est prise en charge à l’Hôpital de Poissy et démarre un traitement par valaciclovir. A 18 semaines d’aménorrhée, l’amniocentèse confirme que le fœtus est infecté et que malgré le traitement, le virus a passé la barrière du placenta. La surveillance devient alors très resserrée. Les échographies se succèdent ainsi que les examens plus poussés à Necker dans le service du Pr Ville, tout en maintenant le traitement. A 6 mois de grossesse, l’IRM fœtale révèle la présence de kystes et de calcification dans le cerveau, signe que Charlotte aura sans doute des séquelles. La peur et l'appréhension dominent cette fin de grossesse.
Charlotte naît au début de l’été 2023 et si sa naissance est un moment heureux, Sarah et son mari se souviennent d’une longue errance : « nous ne savions pas quel serait le degré de handicap de Charlotte. La prise de sang, faite dans les premiers jours, présentait une charge virale très élevée, Charlotte a donc été mise sous un autre traitement antiviral : le valganciclovir. Son bilan auditif est peu encourageant et nous sommes amenés à poursuivre son suivi à l’hôpital Necker. »
Charlotte y passe un examen de référence pour connaître son degré d’atteinte auditive : les PEA (Potentiels Auditifs Évoqués), et pour l’ORL de Necker, les résultats sont clairs : Charlotte est sourde profonde, l’atteinte est bilatérale (des deux oreilles).
« L'annonce résonne comme un coup de tonnerre, mais il faut agir vite, explique Sarah, nous sommes orientés vers le SESSAD de proximité (Services d’Éducation Spéciale et de Soins à Domicile), cet établissement spécialisé suit les enfants sourds. Charlotte démarre son suivi par deux séances d’orthophonie chaque semaine, afin qu'elle puisse être stimulée le plus tôt possible. Nous entrons de plain-pied dans le monde du handicap, on nous parle de la langue des signes et de ses premiers appareils auditifs ». La petite fille est équipée d’appareils auditifs amovibles à conduction osseuse, mais cela ne suffit pas, Charlotte n’entend pas du tout. « Tout s’accélère et entre juillet et janvier, on nous prépare à la mise en place d’implants cochléaires bilatéraux » raconte Sarah. « Notre fille est implantée en février 2024. Au début, des réglages sont nécessaires tous les 15 jours, puis tous les mois. »
La mise en place des implants est très compliquée, la petite Charlotte a eu 8 otites en quelques mois et une d’entre elles a infecté la partie sous-cutanée de l’implant, ce qui a nécessité une hospitalisation. « Depuis l’opération, son seuil d'audition est d'environ 60 Db, elle réagit aux bruits, cherche à faire du bruit, mais elle n’entend pas comme tout le monde et reste malentendante. Nous avons décidé de faire cette opération, car les implants sont, aujourd’hui pour nous, la meilleure prise en charge possible, celle qui peut l’aider à entrer dans le langage oral. Elle choisira son mode de communication plus tard, mais nous aurons fait le maximum pour elle. »
Depuis ses 6 mois, Charlotte est gardée par une assistante maternelle et Sarah a pu reprendre son travail d’enseignante en maternelle. « Mais, elle a beaucoup de RDV médicaux, à la rentrée, elle aura quatre séances d’orthophonie par semaine. Cette année, cela a été très compliqué financièrement. Les dédommagements de la CAF et de la MDPH (Maison Départementale pour les Personnes Handicapées) ne couvrent pas vraiment nos pertes de salaire, donc c’est difficile. Tout est flou, nous devons apprendre à vivre avec ce handicap. Cette période a été très éprouvante pour moi », explique Sarah, « j’ai fait une dépression post-partum. Nous avons eu beaucoup de difficultés à concilier la vie professionnelle et personnelle, car le handicap de Charlotte nécessite énormément de disponibilité. »
Désormais, passé le choc de l’annonce et les épreuves des premiers mois, Sarah et sa famille vivent des moments heureux. « Charlotte est très joyeuse, elle est souriante, sociable et elle interagit très bien avec son entourage. Peter apprend des comptines en langue des signes pour sa petite sœur. Les résultats des implants sont encourageants, les moments difficiles nous ont appris à lâcher prise, on profite plus, on savoure les moments ensemble. Nous sommes reconnaissants du suivi que nous avons. Grâce à l’ADESDA (l’Association Départementale pour l’Éducation Spécialisée des enfants Déficients Auditifs), on rencontre d’autres familles avec des enfants plus âgés que Charlotte, cela nous permet de nous projeter et nous redonne de l’espoir. On vit autrement, mais la vie reste belle. » conclut Sarah, avec un large sourire.
Edoardo et Raphaëlle, déjà parents de Victor âgé de deux ans, attendent leur second enfant lorsque tout commence. « À peine enceinte d’un mois, ma femme a eu une forte fièvre, et notre sage-femme a immédiatement pensé au CMV. Nous avons eu beaucoup de chance dans cette histoire compliquée, car notre prise en charge a été optimale. Nous n’avions absolument aucune connaissance de ce virus et des risques encourus », raconte Edoardo.
Rapidement, une prise de sang confirme une infection au premier trimestre. « Nous comprenons alors que nous sommes dans la situation la plus critique. La grossesse change de visage, passant d’un moment merveilleux à une angoisse quasi-permanente. Nous nous informons beaucoup et intégrons le protocole de suivi de Necker, mis en place par le service du Pr Ville. Le premier enjeu est de déterminer si le virus a été transmis au bébé. Raphaëlle subit une amniocentèse et une ponction fœtale (prélèvement de sang du cordon) qui confirment que notre futur enfant est bien contaminé. Les rendez-vous s’enchaînent, plus de 40 au total, soit une échographie par semaine. Chaque examen est une épreuve. Les équipes cherchent des indices pour évaluer la sévérité des atteintes, comme la taille du bébé, de son foie... Notre bébé, lui, présentait des kystes dans le cerveau. Un traitement par valaciclovir est mis en place dès le troisième mois de grossesse, toutes les 4 heures, mon épouse doit prendre de gros comprimés pour tenter de contenir la charge virale. Le bébé grandit en cercle fermé, il boit le liquide amniotique, urine, et reboit ce liquide, donc le virus se multiplie de façon exponentielle. La grossesse se poursuit, sans que les équipes puissent prédire avec précision le niveau de handicap. Les médecins nous proposent alors d’interrompre la grossesse, c’est un véritable dilemme, dans un contexte de grande vulnérabilité et d’épuisement psychique et physique. La palette des séquelles possibles va du noir au blanc avec une large zone de gris l’enfant à naitre peut présenter un retard mental ou moteur, une cécité, une surdité... on ne sait pas ce que l’on va découvrir. »
Edoardo, ému, attend un moment et reprend le cours de son récit :
« Nous réfléchissons, nous nous informons et décidons de poursuivre la grossesse malgré cette épée de Damoclès au-dessus de nos têtes. Gabriel est né dans un contexte où angoisse et joie se mêlaient. Nous nous réjouissons d’abord, car il n’avait pas de symptômes. Mais très vite, son ouïe commence à diminuer sérieusement. Chaque semaine, nous attendions fébrilement les résultats des tests et son audition baissait. Gabriel a été appareillé, il est suivi par un ORL, un pédiatre de l’hôpital Necker et un audioprothésiste, afin qu’il puisse bénéficier d’une prise en charge efficace. Nous avons la chance de pouvoir compléter ces dispositifs grâce à nos fonds personnels, mais qu’en est-il pour ceux qui sont en difficulté financière ? À l’hôpital, nous avons croisé des enfants très lourdement atteints, ce virus est affreux et peut provoquer de lourdes séquelles. Gabriel a cinq ans et demi désormais et dans six mois, nous aurions dû sortir de la période de surveillance étroite mais l’audition de notre fils continue de baisser. C’est un peu la roulette russe, ce virus avance masqué et ne dévoile pas tout de suite son jeu. Gabriel a des problèmes de diction, certes il grandit dans un univers bilingue (français, italien), mais sa surdité lui confère un réel handicap. Le soir, il est épuisé, il a des migraines, il tolère mal le bruit. Il commence à mal vivre son appareillage. Nous avons dû le changer d’environnement pour qu’il aille dans une école plus adaptée à ses besoins. Le handicap s’appréhende un peu mieux chaque jour et nous apprenons à accepter la faiblesse. Raphaëlle s’est réorientée, elle est devenue psychologue pour se rapprocher de notre enfant. Les séquelles du CMV et le handicap de Gabriel nous font voir la vie autrement. Ma femme a réagi de cette manière, mais pour moi c’est différent. Pour le père, c’est la double peine, la grossesse on ne la vit pas dans sa chair, on est impuissant. Je n’ai raté aucun rendez-vous, j’ai tout vécu avec elle, on s’est battus ensemble, c’était ma façon à moi de me sentir inclus. » poursuit Edoardo.
« Gabriel est aujourd’hui un petit garçon joyeux, qui nous rend fiers. Hier, nous avons assisté à son spectacle de théâtre, il évolue et il nous émeut. Mais nous serons toujours inquiets pour lui, le handicap prend beaucoup de place ».
Edoardo est reconnaissant du suivi médical qu’ils ont eu, mais « nous sommes anéantis par le manque de communication sur ce sujet. Si nous avions été prévenus, nous aurions peut-être pu l’éviter. Les gestes barrières peuvent aider, ils peuvent réduire significativement la circulation de ce virus. Notre rêve c’est que ce virus soit freiné. C’est la première cause de surdité non génétique chez l’enfant aujourd’hui en France. La prévention pourrait mieux armer les futurs parents qui portent toute leur vie la culpabilité de cette contamination. Nous avons eu la chance d’avoir été dépistés, donc nous avons été préparés. Nous sommes à Paris, qu’en aurait-il été ailleurs, là où personne ne parle de ce virus ? Aucune campagne sérieuse n’a été mise en place. Les sage-femmes, les médecins généralistes, les gynécologues alertés sont trop peu nombreux. Ma bataille aujourd’hui : parler de ce virus et alerter ! ». Comme tous les parents d’enfants touchés par le CMV, Edoardo et Raphaëlle attendent que les lignes bougent.
Arantza, une jeune maman de 30 ans, découvre au cours du premier trimestre de sa deuxième grossesse qu’elle est positive au cytomégalovirus, un virus dont elle ignorait l’existence jusque-là. Déjà maman d’un bébé d’un an gardé en crèche, elle a probablement contracté le virus à ce moment-là. « Je connaissais la toxoplasmose, mais le CMV ? C’était totalement inconnu pour moi », raconte-t-elle.
La découverte de cette infection survient lors d’un examen de routine, prescrit par son gynécologue. « Mon gynécologue était très rigoureux. Il effectuait systématiquement des tests pour tout, même ceux qui ne sont pas toujours prescrits, comme le CMV », explique Arantza. À la réception des résultats, elle vérifie d’abord la toxoplasmose, qui s’avère négative. Mais une autre mention attire son attention : « CMV positif. Nous avons souhaité en savoir plus », se souvient-elle.
Arantza est rapidement orientée vers l’hôpital Louis Mourier à Colombes, où elle bénéficie d’un suivi spécialisé avec le Dr Picone. « Dès que j'ai été diagnostiquée, j'ai été prise en charge pour m'assurer que le bébé se développait normalement. Chaque mois, je devais passer des échographies détaillées pour vérifier en particulier le développement du cerveau », explique-t-elle. Ce suivi régulier est essentiel car le CMV peut causer des complications graves chez le fœtus, notamment des troubles neurologiques et auditifs. Pour limiter ces risques, les médecins proposent à Arantza un traitement antiviral à base de valaciclovir, un médicament encore en phase expérimentale à l’époque. « On m’a expliqué que ce traitement pouvait réduire les risques de transmission du virus au bébé, même s’il n’était pas encore largement utilisé. Pour nous, c’était clair qu’il fallait essayer. » Ainsi, dès le deuxième mois de grossesse, elle commence ce traitement. « Le traitement était lourd, avec des doses importantes à prendre chaque jour, mais je me disais que c'était indispensable pour protéger mon enfant. »
Avant la naissance, Arantza rencontre le Pr Natacha Teissier, qui collabore avec le Dr Picone, tous deux spécialistes du CMV. Le Pr Teissier, chef du service d'ORL pédiatrique à l’hôpital Robert-Debré, expose à Arantza les risques de surdité ainsi que le suivi postnatal nécessaire. « Elle nous a expliqué avec une grande clarté ce qu’implique l’infection par le CMV et les points à surveiller. Nous nous sommes sentis accompagnés, même si les incertitudes demeuraient. »
À la naissance de Victoria, les premiers tests à la maternité sont rassurants, mais il a fallu les répéter régulièrement. « Chaque rendez-vous apportait son lot de stress, même si les résultats étaient encourageants. »
En plus des tests auditifs et des rendez-vous de suivi à l’hôpital Robert-Debré, Victoria est soumise à des examens pour vérifier son équilibre, une fonction étroitement liée à l’oreille interne, souvent affectée par le CMV. « Ces tests d’équilibre étaient parfois difficiles pour elle, surtout quand elle était encore petite, mais les équipes de l’hôpital ont toujours su comment la mettre à l’aise et adapter les examens à son âge. Le suivi comprenait également une IRM pour s’assurer qu'il n'y avait pas de lésions cérébrales. Chaque résultat positif nous permettait de respirer un peu mieux. »
Face à son expérience, Arantza ressent le besoin de sensibiliser son entourage. « Dès que j’ai su que j’étais positive au CMV, j’ai commencé à en parler autour de moi. Des copines de copines, et même des personnes que je ne connaissais pas directement, m’ont appelée pour que je leur raconte mon expérience. Je me suis rendu compte que beaucoup de femmes ne sont pas informées du CMV, alors que c’est l’une des principales causes de surdité chez l’enfant en France. C’est dommage que ce soit si peu connu. J’ai eu la chance d’avoir un gynécologue très rigoureux qui a dépisté le CMV, mais ce n’est pas le cas pour tout le monde. »
Aujourd’hui, Victoria est une petite fille de 6 ans en pleine forme, et le suivi médical intensif a pris fin pour une entrée en CP sereine. « Lors de notre dernier rendez-vous avant l’été, le Pr Teissier nous a dit que tout allait bien et que nous pouvions relâcher la surveillance. C’était un soulagement immense. »
En repensant à tout ce qu’elle a traversé, Arantza est reconnaissante du soutien médical qu’elle a reçu. « Je suis convaincue que le traitement et le suivi étroit ont constitué la meilleure prise en charge possible. Nous avons eu beaucoup de chance, et je ne remercierai jamais assez l’équipe médicale pour son soutien et le sérieux de mon suivi. » Et elle conclut avec détermination : « Aujourd’hui, je parle du CMV à toutes les femmes enceintes que je rencontre. C’est trop important pour rester dans l’ombre. »
Anne-Hélène Labissy, qui préside l’association de référence des victimes du CMV, ne partage clairement pas l’avis du HCSP et fait entendre son désaccord.
(Chanter, Marcher, Vivre) est née, il y a 18 ans, dans le but d’accompagner les familles concernées par le CMV. L’association soutient les parents qui découvrent le virus pendant la grossesse mais également ceux qui, après l’accouchement, doivent faire face à ses séquelles.
Anne-Hélène a créé cette association après avoir vécu l’errance, la solitude et la détresse liée aux conséquences du CMV. Désormais, avec cette association, elle peut guider les pas de ces familles touchées et parfois bouleversées par « Ce Maudit Virus » comme elle l’a surnommé. Il y a 19 ans, Anne-Hélène a mis au monde une petite Hermance. Cette deuxième grossesse se déroule à peu près normalement, malgré une troisième échographie très longue qui notait déjà des anomalies, mais personne ne l’alerte de la moindre difficulté. « Dès qu’on l’a posée sur mon ventre, mon instinct de mère m’indique qu’il y a un problème » explique Anne-Hélène.
On la rassure et elle est invitée à ne pas comparer ses bébés, « chaque enfant est différent » lui dit-on à la maternité. Mais 4 mois plus tard, Hermance est atteinte d’une pyélonéphrite sévère et cet épisode infectieux contraint le bébé et sa maman à passer une semaine à l’hôpital.
C’est au cours de cette hospitalisation, qu’enfin un médecin l’écoute avec attention et l’oriente vers un neurologue qui fera passer un bilan complet à sa fille.
Le verdict est sans appel, Hermance est polyhandicapée et cela est dû au cytomégalovirus : son bébé souffrira d’un retard mental, d’un handicap moteur et également d’épilepsie.
Mais Anne-Hélène, qui cumule une énergie et une détermination hors norme, ne baisse pas les bras et mène un véritable combat. Hermance est entourée d’amour et stimulée quotidiennement « chaque jour, c’est un peu la préparation aux Jeux Olympiques à la maison », glisse-t-elle avec humour. Hermance progresse, elle communique en langue des signes et parle un peu, mais elle ne marche pas et se déplace en fauteuil.
Anne-Hélène est en colère, elle se souvient être tombée, à l’époque, sur de la documentation au sujet du CMV, et avoir ainsi demandé à être dépistée. Le gynécologue avait refusé au motif que « ce virus n’était pas grave ».
« Surdité, atteintes visuelles, paralysie cérébrale, handicap mental ou physique, voire décès, les risques du CMV sont pourtant loin d’être anodins » regrette Anne-Hélène.
Mais au-delà de son histoire, ce qui la révolte « c’est l’aveuglement général. J’aurais aimé que l’histoire cesse de se répéter et qu’il y ait enfin une prise de conscience, mais nous sommes dans l’impasse. En 2004, le Haut Conseil de Santé Publique invitait les femmes enceintes à ne pas se faire dépister, mais recommandait la mise en place d’une vraie campagne de communication auprès des parents et des professionnels de santé au sujet des mesures d’hygiène et de prévention à adopter. En 2018, le Haut Conseil pour la Santé Publique (HCSP) a de nouveau refusé ce dépistage. Et en 2024, alors que la connaissance de ce virus a considérablement progressé, nous sommes abasourdis d’entendre que le HCSP s’est à nouveau positionné contre un vrai plan de lutte efficace. Le constat est amer, cela ne fonctionne pas. Aucune mesure n’a été prise, il n’y a pas eu de changement dans les formations initiales, et aucune campagne de santé publique n’a été menée. Nous avons pourtant le pouvoir d’agir en informant, en dépistant et en traitant ces femmes, nous pourrions tous être mieux armés.
Nous déplorons cette nouvelle incitation à l’inaction du HCSP. Cette réponse est une gifle pour toutes les familles qui souffrent des séquelles de ce virus si fourbe et potentiellement si dangereux. » explique Anne-Hélène. « Tout espoir n’est pas perdu car la Haute Autorité de Santé doit également se pencher sur le sujet et rendre ses conclusions d’ici fin 2024. Nous allons continuer de mener cette guerre contre le CMV afin de limiter les dégâts provoqués par ce virus, c’est une question de santé publique. » conclut-elle pleine d’optimisme et de ténacité.

